[applicazioni]
anno 18 numero 35 / 10.23
Biografia
Alessandra Retico è ricercatrice presso la sezione di Pisa dell’INFN. Si occupa di applicazioni della fisica alla medicina e in particolare di tecniche di imaging diagnostico. È coordinatrice nazionale del progetto “Artificial Intelligence in Medicine: next steps” (next_AIM) dell’INFN, relativo allo sviluppo di metodologie basate sull’intelligenza artificiale per analisi di dati e immagini biomediche allo scopo di favorire la medicina di precisione.
Guardarci dentro
Tecniche fisiche di imaging medico
di Alessandra Retico
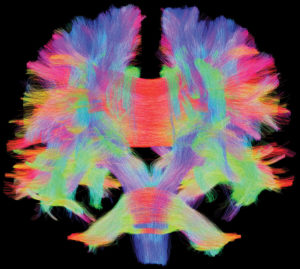
a.
Immagine trattografica ottenuta in risonanza magnetica con una tecnica di acquisizione pesata in diffusione, acquisita ed elaborata presso l’IRCCS Fondazione Stella Maris (Pisa). Viene sfruttato il movimento delle molecole d’acqua nell’ambiente anisotropo costituito dalla materia bianca cerebrale per ricostruire le fibre assonali che la compongono. È l’unica tecnica di imaging che permette di visualizzare le fibre assonali in vivo. In rosso sono rappresentate le fibre che hanno direzione trasversale (sinistra-destra), in verde quelle che vanno in direzione anteroposteriore (ortogonale al foglio), mentre in blu quelle che vanno in direzione verticale (alto-basso).
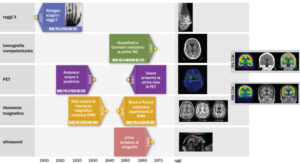
La conoscenza dell’anatomia umana e della funzionalità degli organi affascinò profondamente Leonardo da Vinci, che, a partire dal 1480, si dedicò allo studio del corpo umano rappresentandolo nei suoi disegni con un impressionante livello di dettaglio. Leonardo era un convinto sostenitore del concetto “un’immagine vale più di mille parole”, ed è sicuramente lui l’inventore dell’illustrazione anatomica. Furono però necessari ulteriori quattro secoli per avere la prima immagine anatomica acquisita in vivo. Quando W.C. Röntgen scoprì i raggi X nel 1895, si rese subito conto del loro potenziale rivoluzionario per la medicina. Fu allora che nacque una nuova disciplina: la radiologia. La tecnica messa a punto da Röntgen permetteva, infatti, grazie alla differente capacità di materiali diversi di attenuare i raggi X che li attraversano, di fissare su una pellicola fotografica l’immagine delle “ombre” di ossa e tessuti. A partire da quella memorabile scoperta l’imaging medico si è sviluppato in molteplici direzioni, fino a diventare oggi uno strumento irrinunciabile in ambito sia diagnostico sia terapeutico.
In appena cinque quarti di secolo dalla scoperta di Röntgen, la comunità scientifica e tecnologica ha messo a punto strumenti straordinari per l’indagine non invasiva del corpo umano, allo scopo di assistere i medici nell’identificazione sempre più precoce di segnali patologici.
Le principali tecniche di imaging diagnostico, quali la radiografia (RX), la tomografia assiale computerizzata (TAC), la tomografia a emissione di singolo fotone (SPECT), la tomografia a emissione di positroni (PET), la risonanza magnetica nucleare (RMN) e l’ecografia, hanno visto la luce il più delle volte grazie a scoperte scientifiche e formulazioni matematiche apparentemente molto lontane dal mondo applicativo, e magari note già decenni prima. Per l’impatto che il loro lavoro ha avuto sulla medicina, fisici (Allan M. Cormack, Peter Mansfield), chimici (Paul C. Lauterbur) e ingegneri (Godfrey N. Hounsfield) hanno ricevuto il premio Nobel per questa disciplina. Lo spettro della radiazione elettromagnetica è protagonista, con la sua componente ionizzante, nella maggioranza delle tecniche sopra elencate, a eccezione della risonanza magnetica, che sfrutta radiazioni non ionizzanti. L’ecografia invece non fa uso di radiazioni, ma di onde meccaniche longitudinali con frequenze superiori a quelle udibili (ultrasuoni).
L’RX convenzionale ha il limite di fornire immagini proiettive, in cui dettagli anatomici interessanti possono essere oscurati da strutture sovrapposte.
Grazie all’impiego di rivelatori digitali e al principio di ricostruzione tomografica, la TAC permette di ottenere una mappa tridimensionale molto dettagliata dei tessuti del corpo umano. La ricostruzione tomografica, che consiste nell’elaborare un gran numero di immagini proiettive acquisite a diversi angoli intorno al paziente, è usata anche in SPECT e PET. Queste ultime sono tecniche di medicina nucleare, nelle quali vengono visualizzate le distribuzioni di attività del radioisotopo contenuto in un radiofarmaco che viene somministrato al paziente. Il radiofarmaco, seguendo processi metabolici nel corpo, si accumula nei tessuti di interesse. Distribuzioni differenti da quelle attese in assenza di patologia evidenziano deficit di funzionalità di tessuti e organi.
Un’altra tecnica di imaging tutt’altro che banale è la risonanza magnetica, in cui, insieme alla meccanica quantistica, sono protagonisti ben tre campi magnetici: un campo magnetico statico molto intenso, generato grazie alla tecnologia dei magneti superconduttori, uno oscillante a radiofrequenze (RF) e dei gradienti di campo magnetico (ossia piccole variazioni lineari del campo statico nelle tre direzioni dello spazio). Lo spin non nullo di alcuni nuclei, tra cui quelli degli atomi di idrogeno presenti nel nostro corpo, fornisce loro un momento magnetico che fa sì che essi comincino a oscillare, come piccoli aghi di una bussola, intorno alla direzione del campo magnetico principale al ritmo di una sequenza di impulsi RF, mentre i gradienti di campo si accendono e si spengono. Nuclei di tessuti diversi rispondono con segnali di diversa intensità che hanno frequenze e fasi diverse in base alla loro posizione. Grazie, infine, a una trasformazione matematica (la trasformata di Fourier) si ottengono immagini anatomiche con un contrasto ottimale anche tra tessuti molli, quali quelli del nostro cervello, che supera le capacità della TAC.
L’ecografia invece si basa su fenomeni descritti dalla fisica classica, quali la riflessione di un’onda di ultrasuoni quando incontra un ostacolo e la variazione della frequenza dell’onda nel momento in cui viene riflessa da bersagli in movimento, quali ad esempio le cellule ematiche, per via dell’effetto evidenziato da Doppler nel 1845. Non facendo uso di radiazioni elettromagnetiche, l’ecografia è considerata sicura per i pazienti ed è diventata indispensabile, ad esempio, per seguire l’evoluzione di una gravidanza. Il basso costo della strumentazione e l’assenza di requisiti di installazione rendono questa metodica quella di più facile diffusione anche nei paesi in via di sviluppo.
Già da qualche decennio la ricerca si sta concentrando sulla messa a punto di sistemi di imaging ibridi che sfruttino diversi principi fisici simultaneamente per acquisire informazioni complementari sul corpo umano in una stessa sessione diagnostica. Esistono già implementazioni cliniche di sistemi che combinano SPECT e TAC, PET e TAC oppure PET e RMN, ma quest’ultima combinazione, la cui completa integrazione è diventata possibile solo grazie all’impiego di fotorivelatori a stato solido insensibili ai campi magnetici, necessita ancora di sviluppi dedicati.
La quantificazione delle informazioni contenute nelle immagini digitali, attraverso algoritmi per l’elaborazione e l’analisi di segnali e dati multidimensionali, ha dato vita a un campo di ricerca noto oggi come “radiomica” (vd. [as] riflessi: L’era della medicina in-silico, ndr). Le informazioni provenienti dall’imaging diagnostico, combinate con dati genetici e parametri clinici dei pazienti, ed elaborate anche grazie all’intelligenza artificiale, costituiscono la pietra miliare su cui si sta creando la medicina di precisione.
Infine, c’è sicuramente spazio per l’identificazione di nuove modalità di imaging diagnostico a partire magari dalle applicazioni di principi fisici che nessuno ha ancora pensato di poter mettere a servizio della medicina. La chiave del successo è lavorare in un gruppo multidisciplinare in cui fisici e altri esperti delle scienze dure lavorino a stretto contatto con i medici per identificare problemi e soluzioni, mettendo a frutto la propria inventiva.
Biografia
Alessandra Retico è ricercatrice presso la sezione di Pisa dell’INFN. Si occupa di applicazioni della fisica alla medicina e in particolare di tecniche di imaging diagnostico. È coordinatrice nazionale del progetto “Artificial Intelligence in Medicine: next steps” (next_AIM) dell’INFN, relativo allo sviluppo di metodologie basate sull’intelligenza artificiale per analisi di dati e immagini biomediche allo scopo di favorire la medicina di precisione.